Результаты многокомпонентного теста на 300 аллергенов за 24 часа!
Прием ведущего израильского акушера-гинеколога, репродуктолога!
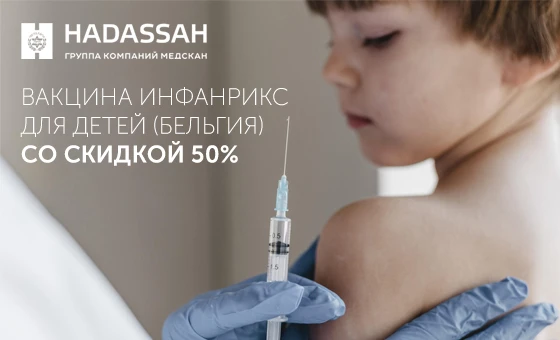
До 30 апреля действует скидка 50% на вакцинацию ребенка препаратом Инфанрикс!
Ведущий израильский специалист в области эндокринологии, диабета и обмена веществ!
Позаботьтесь о своем здоровье во время обострения аллергии!
ОНЛАЙН-КОНСУЛЬТАЦИЯ С ВРАЧАМИ ИЗ ИЗРАИЛЯ
НЕОТЛОЖНАЯ ПОМОЩЬ 24/7
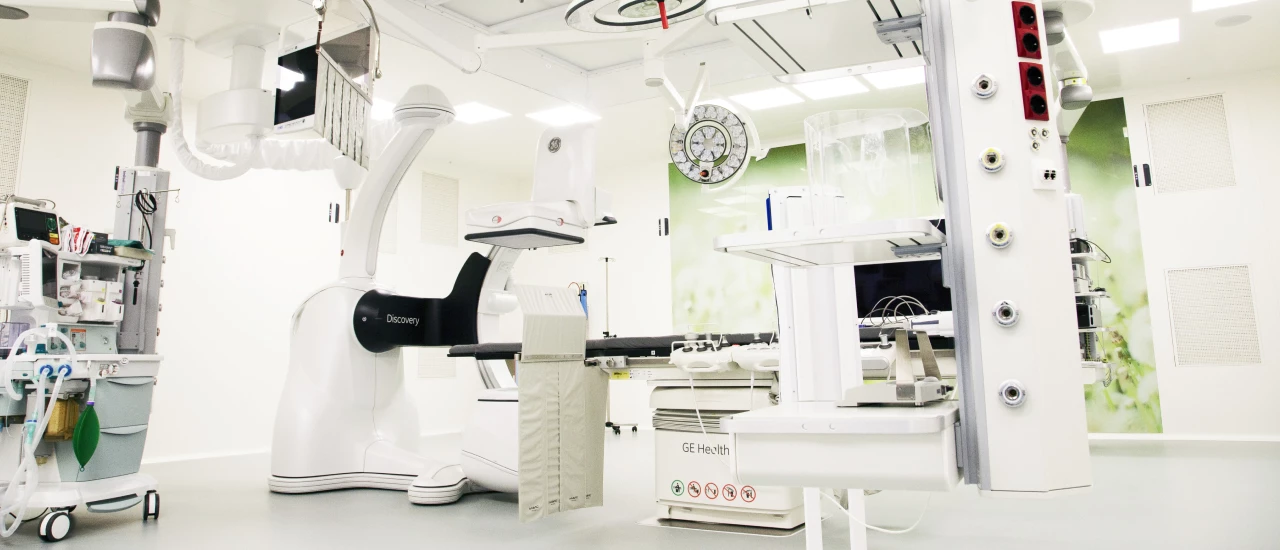


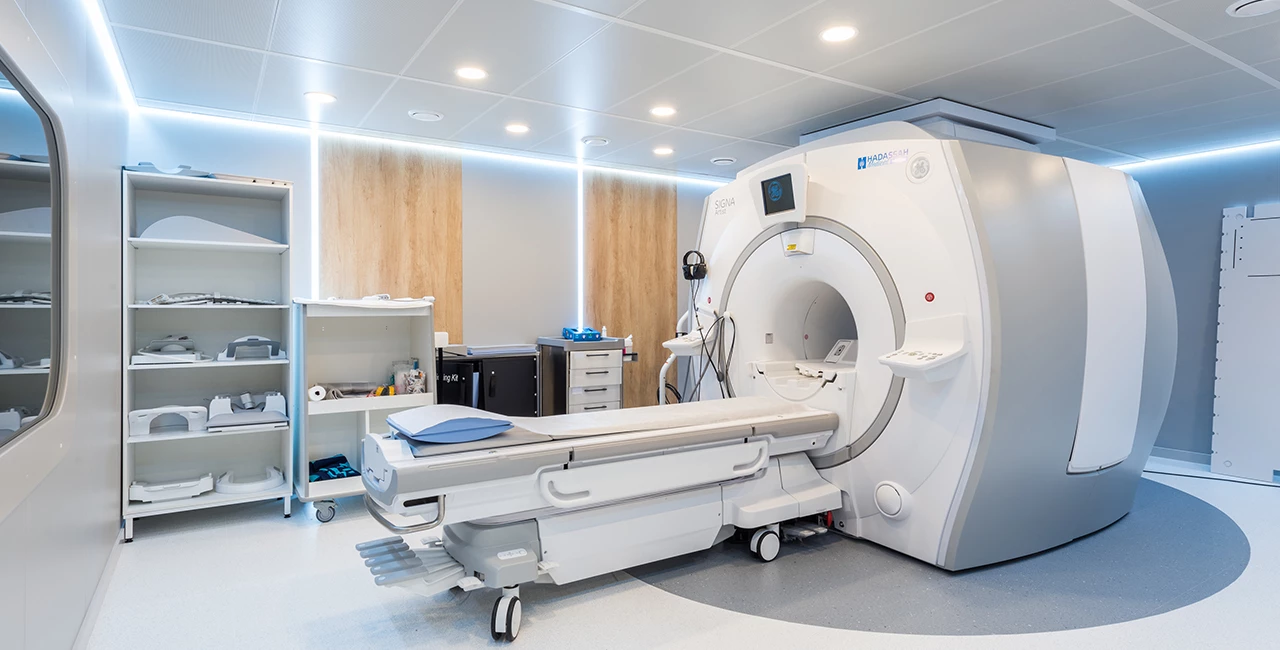
Центры компетенций Hadassah Medical Moscow — это междисциплинарные команды врачей, собранные для выбора и проведения максимально эффективного лечения. Этот подход основывается на международных стандартах оказания медицинской помощи и позволяет обеспечивать лучшее лечение с минимальным хирургическим вмешательством и быструю реабилитацию. В Hadassah функционирует Центр женского здоровья, Центр онкологии и Cердечно-сосудистый Центр.
Центр онкологии
Центр женского здоровья
Сердечно-сосудистый центр
Медицинский центр Hadassah в Сколково
Официальный филиал израильского госпиталя Hadassah Medical Moscow — это центр Израильской медицины в России. Не нужно ехать за границу, чтобы получить качественное лечение. Прием ведут израильские и российские врачи с международным опытом работы. Возможно применение препаратов, не зарегистрированных в России.
Официальный филиал Израильской клиники Hadassah
Международные стандарты лечения
Исцеляющая среда клиники
Контроль качества на каждом этапе
Междисциплинарный подход к лечению
Возможность применения препаратов, не зарегистрированных в РФ
Видеоотзывы
Отзывы
Большая благодарнось оператору Наталья (добавочный номер 2085) клиники Хадасса,в Сколково, я звонила из Туркмении по поводу операции для мамы на тазабедренный сустав, Наталья оперативно все объяснила как и что нам надо сделать ,чтобы попасть на консультацию к врачу дай бог здоровья и удачи таким людям ,которые с первого звонка могут правильно помочь пациенту . Надеемся что консультация и наш визит в клинику и все последующие шаги ,будут также теплыми и профессиональными ,большое спасибо вашему центру.
31 октября была на приеме у доктора Дехисси. Огромная благодарность доктору!!! Очень профессиональный врач и чуткий и внимательный человек!!!
Хочу поблагодарить Линицкую (Меркушину) Анастасию Викторовну врача-оториноларинголога. Очень квалифицированный специалист, внимательный и заботливый доктор. Помогла мне с моей проблемой! Грамотно объяснила, назначила нужное лечение. Желаю профессиональных достижений, большое, большое спасибо!
Хочу выразить благодарность доктору Богданову Алексею Анатольевичу за профессионализм, смелость взять на себя ответственность в сложной клинической ситуации, когда все другие врачи трусливо отказали . Хочу отметить, что у него прекрасно организовано работа в отделении , которое возглавляет Алексей Анатольевич .
Проходила профилактическое обследование в клинике Хадасса,благодаря грамотности,профессионализму доктора маммолога
Климовой Марии Ярославовныю обнаружили своевременно злокачественную опухоль молочной
железы. Хочу выразить ей свою благодарность.
К, сожалению, мы столкнулись с такой страшной болезнью, как онкология…
Оправившись от шока, сразу стали искать варианты больниц, клиник, которые могли подтвердить диагноз и дать надежду на успешное лечение. Посетили все ведущие клиники в Москве, были неоднократно на приеме онкологов-гинекологов. При посещении клиники ХАДАССА, мы познакомились замечательным врачом онкологом Ильиным Антоном Алексеевичем.
На первом приеме он дал нам очень профессионально все пояснения относительно диагноза и объяснил, что единственным лечением является операция. Я очень сильно переживала и волновалась, но доктор вселил в меня надежду на позитивный исход операции и на отличный результат. Так же мы обсудили все в деталях: и все мои опасения, и последствия операции, и ход операции, и восстановление после неё. Доктор был уверен в успешным исходе моего лечения и эта уверенность передалась мне.
Поэтому мы с семьей приняли решение делать эту сложную операцию в клинике Хадасса в Сколково под руководством Антона Алексеевича.
В подготовительный период, при сдаче всех необходимых анализов, я почувствовала себя плохо, поднялась высокая температура, оказался COVID. Клиника, во главе с Антоном Алексеевичем и терапевтом Окольниковой Ириной Александровной сделали и провели в клинике все необходимые назначения (капельницы, медикаментозный лечение) и я быстро пошла на поправку.
На протяжении всего времени Антон Алексеевич был на связи, подбадривал меня, его оптимистичный настрой поддерживал меня, хотя было безумно страшно.
Операция прошла в успешно! За это огромное спасибо Антон Алексеевичу и его замечательный профессиональный команде!!!
На следующий день после операции я начала вставать и ходить, как и обещал мне доктор!!! Спасибо всему персоналу клиники за внимательное отношение, заботу и желание помочь!!!
Доктору Кочерян Инге Энриковне.
Большое спасибо Вам за душевное, бережное отношение к пациентам, высокий профессионализм!
Браво доктор!
Огромная благодарность хирургу Дмитрию Аверину ! Всё от А до Я понятно, оперативно и чётко. Отдельное спасибо Анете Шаова за безупречную организацию.
Отзыв о докторе Богданов А. А. Моя история проста, как у многих. Боль, хождение по врачам, восьмичасовые ожидания консультаций докторов и кандидатов медицинских наук, хотя записана на конкретное время. Разные мнения докторов по установке диагноза, равнодушие в государственных клиниках, отказы в операции и страх, и понимание, что никто ничем не поможет, и уже некуда идти. Люди, если у вас не осталось сил, веры и надежды на помощь — не отчаивайтесь: идите на консультацию и за помощью к Богданову Алексею Анатольевичу. Когда-то легендарный российский клиницист профессор Григорий Захарьин, сказал: «Плох тот врач, после посещения которого больной не чувствует себя лучше». Врач внимательно просмотрел все документы по исследованиям. После общения с Алексеем Анатольевичем в душе появилось спокойствие, а главное — вернулась утраченная надежда. Сегодня я выписалась из клиники после тяжелейшей многочасовой и очень сложной операции. Оперировали меня Богданов Алексей Анатольевич и Витязев Олег Геннадьевич. Я не знаю их научных степеней и научных званий. Для меня это люди, которые дали шанс на дальнейшую жизнь. Сказать, что это хирурги с «золотыми руками и нервами как металл» — это ничего не сказать. Объем проведенного хирургического вмешательства не был под силу и докторам и профессорам медицинских наук, которые рассказывали мне на консультациях, что возможно, а что невозможно по ряду показаний вообще. Но исход везде предрекали один: операция пока не возможна, идите, проходите дальше лечение. Хотя я сама понимала, что тянуть уже больше нельзя. Самочувствие стало совсем печальным. Алексей Анатольевич и Олег Геннадьевич, низкий Вам поклон и океан благодарности за чуткое отношение, внимание и доброту, за высокий профессионализм. Желаю Вам здоровья, бодрости, энергии, оптимизма и больших успехов в любимой профессии! Любите жизнь, во имя которой совершаете великие дела! Пролежав в хирургическом отделении, я поняла, насколько грамотно подобран младший и средний персонал. Здесь работают действительно специалисты в своем деле, готовые прийти на помощь по первому зову тревожной кнопки, неравнодушные к чужой боли и помогающие от сердца с тактом и уважением к пациенту. Хочу сказать огромное спасибо за грамотный подбор персонала руководству хирургического отделения и клиники. Вот так в клинике «Хадасса Медикал» меня спасли и закончился мой 1.5-годичный путь мытарства по больницам. Могу сказать, что прошла их я не мало. […] Мне предстоит сложный путь восстановления и ещё дальнейшее лечение, но сейчас в душе есть уверенность и нет страха, что некуда идти за помощью. Спасибо всем, кто мне помогал. Вы — бригада наилучших из профессии, и победа всегда будет с вами. И спасибо Вам за то, что Вы есть, когда после долгих походов по больницам и клиникам уже стало ясно, что медицины нет, а остался только медицинский бизнес, вдруг Вы показали отчаявшимся, что оказывается есть медики — те, про которых можно сказать: «Это — доктор, которому я верю».
Лысенко Сергей, Казахстан
Живя мы понимаем, что жизнь имеет свое начало и свой конец. Пройдя путь лечения в Августе 2023 года в клинике Hadassah Moscow Medical я понял, что жизнь также имеет и продолжение.
Спасибо Богданову Алексею Анатольевичу, врачу хирургу заведующему хирургическим отделением за оказанное мне оперативное лечение, уверенность в своих действиях и проявленный профессионализм.
Спасибо Деминову Эдгару Эриковичу, лечащему врачу за понимание, стремление добиться наилучшего результата в моем лечении заботясь о проведении всех необходимых пред и после операционных мероприятиях обеспечивая их выполнение в строгом соответсвии и в нужный срок. Проявленный профессионализм, вовлеченность и ежедневный контроль во время лечения и во время восстановительного периода. Спасибо вам
Обращаюсь ко Всему персоналу с кем мне довелось встретиться, со словами огромной благодарности каждому из вас за оказанную мне заботу и лечение.
Всем мира, добра! Клинике процветания. Жизнь имеет продолжение…
Сердечная признательность доктору УЗИ Малике Ахьятовне Барзаевой! Вдумчивое отношение, клиническое мышление, искренняя заинтересованность в благополучии больного. Исключительный профессионализм и — обаяние!
Хочу поблагодарить руководство Госпиталя Хадасса за высочайший уровень новейших технологий и профессионализма всего медицинского персонала!
Особенно хочу выделить ассистента врача Чинчаладзе Дарью. Я с первой минуты была окутана вниманием и заботой о моем комфортном пребывании в госпитале. Весь маршрутный лист был четко продуман до мелочей, что бы не было больших окон ожидания. Дашенька, спасибо🙌 за чуткость к чужой боли, за максимальное участие, на которое не все близкие способны!
Пусть Дашенька Вас окружают, такие же прекрасные отзывчивые люди, как и Вы)))).
Процветания Вам и любимому госпиталю Хадасса!!!!
Благодарю Госпиталь Хадасса за полученную медицинскую помощь с участием высококлассного хирурга Ильина Антона, который провел мне сложную операцию и уверенна лучше никто бы и не сделал!!! Начиная с он-лайн консультации и заканчивая днем выписки с последующим вниманием! Браво доктор!!! Благодарю, желаю вам здоровья🙏🏻🙏🏻🙏🏻
Больничная обстановка всегда заставляла меня плакать и нервничать, но благодаря медперсоналу клиники Hadassah мое пребывание там было расслабленным и даже приятным. Красивое здание, современное оборудование, палаты, где продумана каждая мелочь и, конечно, самые талантливые и профессиональные врачи.
Низкий поклон гениальным гинекологам: Аминовой Лиане Назимовне и Алимовой Ольге Сергеевне. Поверьте, этому дуэту по плечу самые тяжелые и нестандартные случаи. Они Вам точно помогут. Потому что это – врачи от Бога.
После операции меня передали в надежные руки специалисту мирового масштаба Чичикову Евгению Игоревичу (химиотерапевт-онколог), высокопрофессиональный и внимательный врач.
Спасать людей – очень тяжелая профессия, а эти доктора вкладывают в пациентов свое сердце и душу.
Герои воюют и носят военную форму, а СУПЕРГЕРОИ нас спасают и носят медицинскую форму клиники Hadassah.
От всей души выражаю глубокую, искреннюю благодарность доктору медицинских наук, доценту ВАК, профессору кафедры онкологии и паллиативной медицины РМАНПО, врачу-эндоскописту Ольге Александровне Малиховой за выполненную мне уникальную операцию, чуткое отношение, внимание!
9 февраля 2023г. Ольга Александровна выполнила гастроскопическое исследование.
19 февраля 2023г. доктор провела мне операцию — эндоскопическая подслизистая диссекция нейроэндокринной опухоли желудка с биопсией, по новейшей эндоскопической методике. Раковая опухоль была убрана хирургическим методом, но с сохранением желудка!
Для меня операция прошла легко, одни сутки в стационаре. Через 4 дня по результатам гистологического исследования была уточнена значительно в меньшую сторону стадия рака, поставлен верный диагноз и рекомендованы контрольные обследования каждые три месяца.
Спасибо Вам Ольга Александровна и всему персоналу Вашей замечательной клиники за тот труд, который изо дня в день Вы выполняете и дарите шанс на долгую счастливую жизнь! Пусть Вам всем всегда сопутствует удача, счастье и благополучие, а главное крепкого Вам всем здоровья! Огромное спасибо!
Хотел бы выразить благодарность доктору Барзаевой М.А(УЗИ брюшной полости) спасибо за грамотную консультацию как врача, качественную диагностику с определением точного диагноза. На самом деле таких врачей редко встретишь которые очень любят свое дело которым не посредственно занимаются.
Добрый день,
Хочу поблагодарить персонал клиники и особенно Валентину (менеджера сопровождения) за прекрасную организацию check up. Благодаря ее профессионализму все прошло на отлично. Отзывчивый, доброжелательный человек.
С уважением,
Игорь
Выражаю огромную благодарность команде врачей отделения Педиатрии.
Первый раз обратились к педиатру в Хадассе чуть меньше года назад в ситуации, когда в двух других клиниках не смогли помочь. В Хадассе составили схему лечения и через 2 недели ребенок был полностью здоров!
Отдельно хочу отметить врачей Волкову Марию Владимировну и Максимова Андрея Владимировича, это профессионалы своего дела. Именно с ними ребенок перестал бояться врачей. Благодарю!
Добрый день! Выражаю благодарность медсестре онкологического отделения дневного стационара Мамбетовой Рузане Хатауовне за чуткое, внимательное отношение к пациенту и профессиональный подход. В настоящий момент прохожу лечение в клинике и очень ценю такое отношение!
Благодарственное письмо
Мы, больные часто после пребывания в больнице выражаем благодарность врачам, потому что, конечно, их профессионализм позволяет нам поправить своё здоровье. Но в тоже время не меньшее значение имеет отношение к больному младшего медицинского персонала. Естественно, что пребывание в больнице сказывается на моральном состоянии больного и работа младшего медицинского персонала позволяет больному легче перенести боли, переживания и вообще повысить моральный дух больного. Поэтому я хочу выразить глубокую благодарность медсестре З. Алиевой, которая с большой добротой и постоянной заботой значительно улучшила моё общее состояние вовремя пребывания в клинике.
Побольше бы таких работников.
Ваш отзыв
Вы можете оставить своей отзыв о клинике.
Врачи клиники
Врачи из Израиля
Associates - наши партнеры
Новости
Написать руководителю филиала

Ирина Заломнова
Руководитель филиала Hadassah в Сколково
Я как руководитель филиала лично заинтересована, чтобы ваш опыт взаимодействия с клиникой Hadassah был максимально приятным и успешным. Я открыта к любым вашим комментариям и предложениям о работе нашей клиники.
Напишите мне и я обязательно вернусь к вам с ответом в ближайшее время.
Преимущества клиники Hadassah
Наша клиника








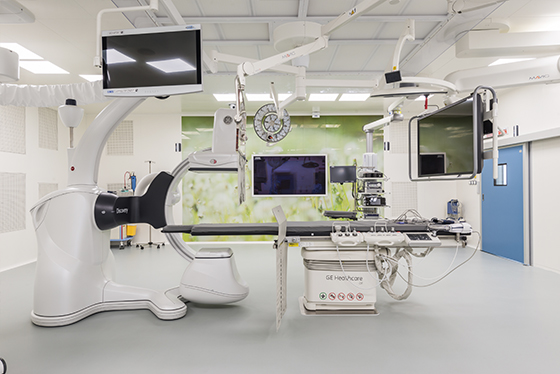
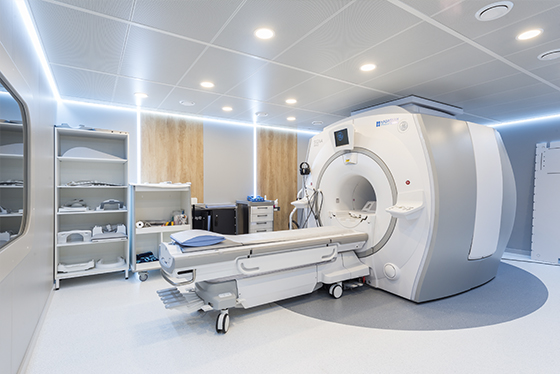












































































































































Ваш отзыв
Вы можете оставить своей отзыв о клинике.